تصویربرداری تشدید مغناطیسی کارکردی حالت استراحت
تصویربداری تشدید مغناطیسی کارکردی حالت استراحت (rsfMRI یا R-fMRI)روشی از تصویربرداری تشدید مغناطیسی کارکردی است که برای اندازهگیری آن دسته از فعلوانفعالات نواحی مغز، که در حالت استراحت اتفاق میافتد، بهکار میرود. یعنی در هنگامی سوژه هیچ وظیفهٔ معینی انجام نمیدهد[۱][۲] فعالیتهای مغزی درحالت استراحت را از طریق تغییرات جریان خون در مغز میسنجند. این تغییرات منجر به تولید سیگنالی با عنوان سیگنال وابسته به سطح اکسیژن خون (BOLD) میشود که با fMRI قابل اندازهگیری است. ازآنجا که مغز بهطور طبیعی - حتی درغیاب محرک خارجی یا انجام وظیفهٔ مشخص- در حال فعالیت است، سیگنال BOLD هریک از نواحی مغز نوساناتی خودبهخودی را نشان میدهد. رویکرد حالت استراحت در مطالعات fMRI، برای کشف سازوکارهای کارکردی مغز و اینکه آیا این سازوکارها تحت بیماریهای نورولوژیک یا روانی تغییر میکنند یا خیر به کارمیآید. تحقیقات بر روی ارتباطات کارکردی مغز در حالت استراحت منجر به پیدایش شبکههایی در مغز شدهاست که نواحی متعلق به هریک از این شبکهها با الگوی مشخصی باهم فعالیت میکنند.[۳][۴][۵]
اصول fMRI[ویرایش]
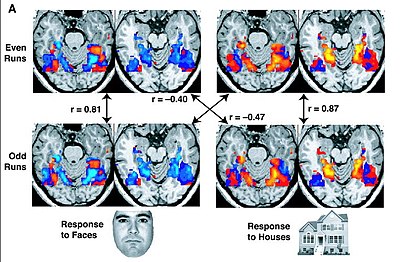
تصویربرداری تشدید مغناطیسی کارکردی (fMRI) نوع خاصی از تصویربرداری تشدید مغناطیسی است که فعالیتهای مغز را به کمک تغییرات جریان خون میسنجد. به بیان دقیقتر فعالیت مغزی به وسیلهٔ سیگنال BOLD با فرکانس پایین اندازهگیری میشود.
رویهٔ آن مشابه MRI است با این تفاوت که این روش تفاوت مغناطیس شوندگی خون پراکسیژن و خون کماکسیژن را سنجهٔ اصلی خود قرار میدهد. ماحصل این اندازهگیری را با تصاویر گرافیکی که در آن رنگهای مختلف بیانگر شدت فعالیت در سطح مغز است، نشان میدهند. ازنظر رزولوشن مکانی این روش میتواند فعالیت را در ناحیهای از مغز با ابعاد چند میلیمتر را جانمایی کند اما از حیث دقت زمانی عملکرد آن کمتر مطلوب است و با روشهای معمول به دقت زمانی بهتری از چند ثانیه دست نمییابد. یعنی فعالیت را در طول یک بازهٔ زمانی چند ثانیهای ثبت میکند.[۶]
fMRI هم درکارهای پژوهشی و هم - البته با گستردگی کمتر- در کاربردهای کلینیکی مورد استفاده است. به علاوه میتوان آن را به صورت توأمان با سایر روشهای اندازهگیری فیزیولوژی مغز مانند EEG یا NIRS به کاربرد.
اساس فیزیولوژیک[ویرایش]
در fMRI مبتنی بر BOLD حساسیت زمانی، یعنی این که چقدر دقیق میتوان تعیین کرد نورونها چه زمان فعال هستند، به طورعمده متأثر از پاسخ فیزیولوژیک جریان خون است. پارامتر اصلی رزولوشن زمانی نرخ نمونه برداری، یا TRاست. این پارامتر تعیین میکند که یک برش تصویر با چه تکراری تحریک میشود و سپس فرصت پیدا میکند مغناطیسشدگیاش را از دست دهد. مقدار TR بین مقادیری بسیار کوچک (۵۰۰ میلیثانیه) تا فواصل بسیار طولانیتر (۳ ثانیه) متغیر است. مشخصاً در مورد fMRI، پاسخ همودینامیک حدود ۱۰ ثانیه طول میکشد. در ابتدا به صورت ضربی (یعنی با ضریبی از مقدار فعلی آن) صعوی است، در زمانی بین ۴ تا ۶ ثانیه پیک میزند و سپس به صورت ضربی نزولی میشود. تغییر در سیستم خونرسانی (vascular system) برآیند پاسخ به فعالیتهای عصبی در طول زمان را نشان میدهد. از آنجا که پاسخ همودینامیک ذاتاً تابعی لًخت و پیوستهاست، افزایش نرخ نمونه برداری با افزایش TR تنها منجر به ثبت نوسانات سریعتر، مانند سیگنال تنفسی و ضربان قلب میشود؛ نه ثبت دقیق تر سیگنال ناشی از فعالیت عصبی مغز.[۷]
با اینکه fMRI سعی در اندازهگیری فعالیت عصبی مغز به کمک سیگنال BOLD دارد، این سیگنال میتواند متأثر از عوامل فیزیولوژیک متعدد دیگری به جز فعالیت عصبی باشد. برای مثال نوسانات تنفسی و سیستم قلبی-عروقی روی سیگنال BOLD که در مغز اندازهگیری میشود اثر گذاشته و بنابراین سعی میشود درطی پردازش دادههای خام fMRI حذف شوند. نظر به این منابع نویز موجود، در برهههای آغازین استفاده از fMRI بسیاری از متخصصان موضعی شکاکانه نسبت به ایدهٔ fMRI در حالت استراحت اتخاذ میکردند و تنها در دوران اخیر بوده که پژوهشها اطمینان حاصل کردند که سیگنالهای اندازهگیری شده آرتیفکتهایی ناشی سایر عملکردهای فیزیولوژیک نیست.[۸]
بهارات بیزوال (Bharat Biswal)[ویرایش]
- در سال 1992 بهارات بیزوال کار خود را به عنوان دانشجوی کارشناسی ارشد در کالج پزشکی ویسکانسین تحت هدایت مشاور خود جیمز هاید (James S. Hyde) شروع کرد و کشف کرد که مغز حتی در هنگام استراحت حاوی اطلاعاتی دربارهٔ تشکیلات کارکردی خود است. او با استفاده از fMRI به مطالعهٔ چگونگی برقراری ارتباط بین نواحی مختلف مغز، هنگامی که مغز در حال استراحت است و هیچ وظیفهٔ فعالی را انجام نمیدهد پرداخت.. هر چند در آن زمان این پژوهش Biswal عمدتاً نادیده گرفته میشد و آن را به دیگر منابع سیگنال نسبت میدادند، روش تصویربرداری عصبی حالت استراحت که او معرفی کرد در حال حاضر بهطور گسترد مورد توجه است و به عنوان روشی معتبر برای نقشهبرداری شبکههای مغز شناخته میشود. نقشهبرداری فعالیت مغز در حالی که بدن در حالت استراحت امکانات بالقوّهٔ بسیاری برای تحقیق دربارهٔ مغز دراختیار دارد و حتی به پزشکان در تشخیص بیماریهای مختلف مغزی کمک میکند.
ارتباط[ویرایش]
کارکردی[ویرایش]
ارتباط کارکردی، ارتباط بین نواحی مغز است که مشخصههای کارکردی یکسانی دارند. به بیان دقیقتر میتوان آن را همبستگی زمانی بین فعالیتهای نوروفیزیولوژیکی که دور از هم رخ میدهند دانست.[۹] ارتباط کارکردی را هم در مطالعات حالت استراحت و هم در مطالعات مبتنی بر وظیفه میتوان بررسی کرد. با اینکه ارتباط کارکردی به همبستگی بین سوژهها، بلوکها، اجراهای مختلف آزمایش، یا زمانهای مختلف یک آزمایش اطلاق میشود، ارتباط کردی حالت استراحت به دنبال همبستگی زمانی در سیگنال BOLD شخص است، هنگامی که در وضعیت آسودگی و استراحت قرار دارد.[۱۰] ممکن است روزی MRI ارتباط کارکردی (fcMRI) در هردو قسم fMRI حالت استراحت و مبتنی بر وظیفه، به تشخیص قطعیتر بیماریهای روانی مانند اختلال دوقطبی کمک کند، یا در فهم چگونگی پیشرفت اختلال استرسی پس از آسیب روانی و همینطور ارزیابی اثر درمان مؤثر واقع شود[۱۱] برای توصیف رفتار شبکهای که در پس عملکردهای شناختی سطح بالا است، بهکارگیری ارتباط کارکردی پیشنهاد شدهاست. چراکه برخلاف ارتباط ساختاری، ارتباط کارکردی معمولاً در مقیاس ثانیه تغییر میکند. چنانکه در ارتباط کارکردی پویا (به انگلیسی: dynamic functional connectivity)
ساختاری[ویرایش]
ارتباط ناحیههایی از مغز که به صورت فیزیکی یا آناتومی به یکدیگر متصل هستند را ارتباط ساختاری گویند. برای وجود ارتباط کارکردی بین بخشهای مغز الزاماً نباید آن نواحی به صورت ساختاری متصل باشند. کمااینکه وجود اتصال ساختاری نیز لزوماً به معنی وجود ارتباط کارکردی نیست.[۱۲] چندین پروژههٔ نوپا، ازجمله پروژه human connectome در تلاشند نقشهای از ارتباطات عصبی انسان بسازند که چگونگی ارتباطات ساختاری و کارکردی را برای ما روشن خواهد کرد.[۱۳]
شبکهها[ویرایش]
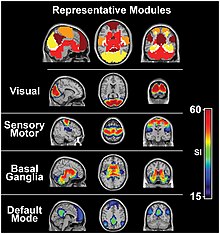
برخی از شبکههای حالت استراحت[ویرایش]
- بسته به روش تحلیل حالت استراحت، پژوهشهای حوزهٔ ارتباطات کارکردی، به شبکههای عصبی متعددی دست پیدا کردهاند که در حالت استراحت از نظر کارکردی کاملاً باهم مدر ارتباطند. در این بین شبکههای کلیدی که بیشتر از بقیه معرفی شدهاند عبارتند از: DMN، شبکهٔ حسی/حرکتی، کنترل اجرایی، سه شبکهٔ بینایی مختلف، شبکهٔ شنوایی، و شبکهٔ زمانی/جداری.[۱۴] همانطور که تا به اینجا گفته شد، این شبکهها شامل مناطقی از مغز است که از نظر آناتومی جدا از هم، ولی از حیث کارکرد مرتبطند و هبستگی شدیدی بین سیگنال BOLD آنها مشاهده میشود. بهرغم روشهای گوناگون دریافت و پردازش دادهها، این شبکهها در پژوهشهای مختلف ثابت بودهاند.[۱۵] مهمتر از همه، بیشتر این شبکههای حالت استراحت، شبکههای کاکردی هستند که پیشازین شناخته شدهاند. منظور از شبکههای کارکردی مناطقی هستند که بار انجام و اشتراک افعال شناختی را به دوش دارند
مشکلات بالقوه[ویرایش]
مشکلات بالقوه در هنگام استفاده از rsfMRI در تشخیص شبکههای کارکردی کثیف شدن سیگنال BOLD تحت اثر منابع نویز فیزیولوژیک مانند ضربان قلب و تنفس[۱۶][۱۷] و حرکت سر است.[۱۸][۱۹][۲۰][۲۱] بسیار مهم است که محققانی که rsfMRI را به کار میگیرند متوجه این عوامل مخدوشکننده باشند؛ چراکه معمولاً این عوامل در مواردی که گروه بیماران با گروه افراد سالم مقایسه میشوند روی جهتگیری آزمایش و استنباط نتایج اثر میگذارد. (به عنوان مثال ممکن است همبستگی کمتری در شبکه حالت پیش فرض بیماران مشاهده شود، حال این که افراد این گروه نسبت به گروه سالم حرکت بیش تری درحین اسکن داشتهاند). همچنین نشان داده شدهاست که استفاده از رگرسیون سراسری میتواند بین تعداد کمی از سیگنالها (مثلاً دو یا سه تا) به اشتباه همبستگی نشان دهد.[۲۲] خوشبختانه مغز سیگنالهای بسیاری دارد.[۲۳]
کاربردهای فعلی و آینده[ویرایش]
پژوهشهای fMRI حالت استراحت قابلیت آن را دارند تا در کاربردهای کلینیکی مورد استفاده قرار گیرند. از جمله در ارزیابی بسیاری از بیماریها و اختلالات روانی.[۲۴]
وضعیت بیماری و تغییرات در ارتباطات کارکردی حالت استراحت
- [۲۵][./Resting_state_fMRI#cite_note-Li-49 [49]]بیماری آلزایمر: کاهش ارتباط
- اختلال خفیف شناختی: ارتباط غیرطبیعی[۲۶]
- اوتیسم: تغییر ارتباط[۲۷][۲۸]
- افسردگی و اثرات درمان ضد افسردگی: ارتباط غیرطبیعی[۲۹][۳۰][۳۱][۳۲]
- اختلال دو قطبی و اثر تثبیت کنندههای خلق و خوی: ارتباطات و مشخصات غیرعادی شبکه ها[۳۳][۳۴]
- اسکیزوفرنی: شبکههای مختل شده[۳۵]
- اختلال بیش فعالی کمبود توجه (ADHD): تغییر «شبکههای کوچک» و تغییرات در تالاموس[۳۶]
- پیری مغز: اختلال در سیستمهای مغز و شبکههای حرکتی
- صرع: اختلال و کاهش/افزایش ارتباط
- [۳۷]
- بیماری پارکینسون: تغییر ارتباط[۳۸]
- اختلال وسواسی-اجباری:افزایش/کاهش در ارتباط[۳۹]
- اختلال در: تغییر ارتباط[۴۰][۴۱]
- بی اشتهایی عصبی:تغییر در اتصال مدارات corticolimbic و قشر اینسولار[۴۲]
انواع دیگری از کاربردهای کلینیکی حال و آینده برای fMRI حالت استراحت شامل شناسایی تفاوتهای گروهی در بیماریهای مغزی، حصول اطلاعات تشخیصی و پیش آگاهانه، اطلاعات، مطالعات طولی و اثرات درمان، دستهبندی حالات نامتعارف بیماری، و نقشه برداری پیش از عمل.[۴۳] ازآن جا که اندازهگیریهای حالت استراحت نیازمند فرامین شناختی نیست، بیمارانی که قادر به انجام وظایف شناختی نیستند نیز به راحتی مورد بررسی قرار میگیرند.
منابع[ویرایش]
- ↑ Biswal, B. B. (2012). "Resting state fMRI: A personal history. [Review]". NeuroImage. 62 (2): 938–944. doi:10.1016/j.neuroimage.2012.01.090.
- ↑ Buckner, RL; Krienen, FM; Yeo, BT (2013). "Opportunities and limitations of intrinsic functional connectivity MRI". Nature Neuroscience. 16 (7): 832–837. doi:10.1038/nn.3423.
- ↑ Biswal, B. B. (2011). "Resting State Functional Connectivity". Biological Psychiatry. 69 (9): 200S–200S. doi:10.1016/j.biopsych.2011.03.032.
- ↑ Rosazza, C.; Minati, L. (2011). "Resting-state brain networks: literature review and clinical applications". Neurol Sci. 32 (5): 773–785. doi:10.1007/s10072-011-0636-y.
- ↑ Cole, David M. & Smith, Stephen M. & Beckmann, Christian F. (2010) "Advances and pitfalls in the analysis and interpretation of resting-state FMRI data." Frontiers in systems neuroscience 4
- ↑ Bandettini, P. A. (2009). "Seven topics in functional magnetic resonance imaging". J Integr Neurosci. 8 (3): 371–403. doi:10.1142/s0219635209002186. PMC 3143579.
- ↑ Huettel, S. A. ; Song, A. W. ; McCarthy, G. (2009), Functional Magnetic Resonance Imaging (2 ed.), Massachusetts: Sinauer, شابک ۹۷۸−۰−۸۷۸۹۳−۲۸۶−۳
- ↑ Damoiseaux, J. S.; Rombouts, S.; Barkhof, F.; Scheltens, P.; Stam, C. J.; Smith, S. M.; et al. (2006). "Consistent resting-state networks across healthy subjects". Proceedings of the National Academy of Sciences of the United States of America. 103 (37): 13848–13853. Bibcode:2006PNAS..10313848D. doi:10.1073/pnas.0601417103. PMC 1564249. PMID 16945915.
{{cite journal}}: Explicit use of et al. in:|last7=(help) - ↑ Biswal, B. B.; VanKylen, J.; Hyde, J. S. (1997). "Simultaneous assessment of flow and BOLD signals in resting-state functional connectivity maps". NMR in Biomedicine. 10 (4–5): 165–170. doi:10.1002/(sici)1099-1492(199706/08)10:4/5<165::aid-nbm454>3.0.co;2-7.
- ↑ Friston, K (2009). "Causal Modelling and Brain Connectivity in Functional Magnetic Resonance Imaging. [Editorial Material]". PLOS Biology. 7 (2): 220–225. doi:10.1371/journal.pbio.1000033.
- ↑ Smith, S. M. (2012). "The future of FMRI connectivity". NeuroImage. 62 (2): 1257–1266. doi:10.1016/j.neuroimage.2012.01.022.
- ↑ Biswal, B. B.; Mennes, M.; Zuo, X. N.; Gohel, S.; Kelly, C.; Smith, S. M.; et al. (2010). "Toward discovery science of human brain function". Proc Natl Acad Sci U S A. 107 (10): 4734–4739. Bibcode:2010PNAS..107.4734B. doi:10.1073/pnas.0911855107.
{{cite journal}}: Explicit use of et al. in:|last7=(help)CS1 maint: Explicit use of et al. (link) - ↑ Van Essen, D. C.; Ugurbil, K. (2012). "The future of the human connectome. [Review]". NeuroImage. 62 (2): 1299–1310. doi:10.1016/j.neuroimage.2012.01.032.
- ↑ Moussa, M. N.; Steen, M. R.; Laurienti, P. J.; Hayasaka, S. (2012). "Consistency of network modules in resting-state FMRI connectome data". PLOS ONE. 7 (8): e44428. Bibcode:2012PLoSO...744428M. doi:10.1371/journal.pone.0044428.
- ↑ Lee, M. H.; Hacker, C. D.; Snyder, A. Z.; Corbetta, M.; Zhang, D. Y.; Leuthardt, E. C.; et al. (2012). "Clustering of Resting State Networks". PLOS ONE. 7: 7. Bibcode:2012PLoSO...740370L. doi:10.1371/journal.pone.0040370.
{{cite journal}}: Explicit use of et al. in:|last7=(help)CS1 maint: Explicit use of et al. (link) - ↑ Birn, R.M.; Diamond, J.B.; Smith, M.A.; Bandettini, P.A. (2006). "Separating respiratory-variation-related fluctuations from neuronal-activity-related fluctuations in fMRI". NeuroImage. 31: 1536–1548. doi:10.1016/j.neuroimage.2006.02.048.
- ↑ Chang, C. , Glover, G.H. , 2009. Relationship between respiration, end-tidal CO(2), and BOLD signals in resting-state fMRI. Neuroimage.
- ↑ Ing, A; Schwarzbauer, C (2012). "A dual echo approach to motion correction for functional connectivity studies". NeuroImage. 63: 1487–1497. doi:10.1016/j.neuroimage.2012.07.042.
- ↑ Van Dijk, K.R.A.; Sabuncu, M.R.; Buckner, R.L. (2012). "The influence of head motion on intrinsic functional connectivity MRI". NeuroImage. 59: 431–438. doi:10.1016/j.neuroimage.2011.07.044.
- ↑ Power, J.D.; Barnes, K.A.; Snyder, A.Z.; Schlaggar, B.L.; Petersen, S.E. (2012). "Spurious but systematic correlations in functional connectivity MRI networks arise from subject motion". NeuroImage. 59: 2142–2154. doi:10.1016/j.neuroimage.2011.10.018.
- ↑ Satterthwaite, T.D.; Wolf, D.H.; Loughead, J.; Ruparel, K.; Elliott, M.A.; Hakonarson, H.; Gur, R.C.; Gur, R.E. (2012). "Impact of in-scanner head motion on multiple measures of functional connectivity: relevance for studies of neurodevelopment in youth". NeuroImage. 60: 623–632. doi:10.1016/j.neuroimage.2011.12.063.
- ↑ Saad, Z.S.; Gotts, S.J.; Murpy, K.; Chen, G.; Jo, H.J.; Martin, A.; Cox, R.W. (2012). "Trouble at Rest: How Correlation Patterns and Group Differences Become Distorted After Global Signal Regression". Brain Connectivity. 2: 25–32. doi:10.1089/brain.2012.0080.
- ↑ Cordes, D.; Nandy, R.R. (2006). "Estimation of the intrinsic dimensionality of fMRI data". NeuroImage. 29: 145–154. doi:10.1016/j.neuroimage.2005.07.054.
- ↑ Holtbernd, F.; Eidelberg, D. (2012). "Functional brain networks in movement disorders: recent advances". Current Opinion in Neurology. 25 (4): 392–401. doi:10.1097/wco.0b013e328355aa94.
- ↑ Li, R. , Wu, X. , Chen, K. , Fleisher, A. S. , Reiman, E. M. , & Yao, L. (2012). Alterations of Directional Connectivity among Resting-State Networks in Alzheimer Disease. AJNR Am J Neuroradiol.
- ↑ Liang, P.; Wang, Z.; Yang, Y.; Li, K. (2012). "Three subsystems of the inferior parietal cortex are differently affected in mild cognitive impairment". Journal of Alzheimer's Disease. 30 (3): 475–487. doi:10.3233/JAD-2012-111721.
- ↑ Müller, R-A.; Shih, P.; Keehn, B.; Deyoe, J.; Leyden, K.; Shukla, D. (2011). "Underconnected but how? A survey of functional connectivity MRI studies in autism spectrum disorders". Cerebral Cortex. 21 (10): 2233–2243. doi:10.1093/cercor/bhq296.
- ↑ Vigneshwaran S, Mahanand B. S. , Suresh S, Sundararajan N. Identifying differences in brain activities and an accurate detection of autism spectrum disorder using resting state functional-magnetic resonance imaging: A spatial filtering approach. Medical image analysis. 2017;35:375–389. doi:10.1016/j.media.2016.08.003.
- ↑ Anand, A; Li, Y; Wang, Y; Wu, J; Gao, S; Kalnin, A; et al. (2005). "Activity and connectivity of mood regulating circuit in depression: a functional magnetic resonance study". Biological Psychiatry. 57 (10): 1079–88. doi:10.1016/j.biopsych.2005.02.021.
{{cite journal}}: Explicit use of et al. in:|last7=(help)CS1 maint: Explicit use of et al. (link) - ↑ Greicius, MD; Flores, BH; Menon, V; Glover, GH; Solvason, HB; Kenna, H; et al. (2007). "Resting-State Functional Connectivity in Major Depression: Abnormally Increased Contributions from Subgenual Cingulate Cortex and Thalamus". Biological Psychiatry. 62 (5): 429–37. doi:10.1016/j.biopsych.2006.09.020. PMC 2001244. PMID 17210143.
{{cite journal}}: Explicit use of et al. in:|last7=(help) - ↑ Anand, Amit; Li, Yu; Wang, Yang; Wu, Jingwei; Gao, Sujuan; Bukhari, Lubna; Mathews, Vincent P; Kalnin, Andrew; Lowe, Mark J (July 2005). "Antidepressant Effect on Connectivity of the Mood-Regulating Circuit: An fMRI Study". Neuropsychopharmacology (به انگلیسی). 30 (7): 1334–1344. doi:10.1038/sj.npp.1300725. ISSN 1740-634X.
- ↑ Anand, Amit; Li, Yu; Wang, Yang; Gardner, Kathryn; Lowe, Mark J. (2007-07-01). "Reciprocal Effects of Antidepressant Treatment on Activity and Connectivity of the Mood Regulating Circuit: An fMRI Study". The Journal of Neuropsychiatry and Clinical Neurosciences. 19 (3): 274–282. doi:10.1176/jnp.2007.19.3.274. ISSN 0895-0172.
- ↑ Altinay, Murat I.; Hulvershorn, Leslie A.; Karne, Harish; Beall, Erik B.; Anand, Amit (2015-12-20). "Differential Resting-State Functional Connectivity of Striatal Subregions in Bipolar Depression and Hypomania". Brain Connectivity. 6 (3): 255–265. doi:10.1089/brain.2015.0396. ISSN 2158-0014.
- ↑ Altinay, Murat; Karne, Harish; Anand, Amit. "Lithium monotherapy associated clinical improvement effects on amygdala-ventromedial prefrontal cortex resting state connectivity in bipolar disorder". Journal of Affective Disorders. 225: 4–12. doi:10.1016/j.jad.2017.06.047.
- ↑ Venkataraman, A.; Whitford, T. J.; Westin, C. F.; Golland, P.; Kubicki, M. (2012). "Whole brain resting state functional connectivity abnormalities in schizophrenia". Schizophrenia Research. 139 (1–3): 7–12. doi:10.1016/j.schres.2012.04.021.
- ↑ Uddin, L. Q.; Kelly, A. M. C.; Biswal, B. B.; Margulies, D. S.; Shehzad, Z.; Shaw, D.; et al. (2008). "Network homogeneity reveals decreased integrity of default-mode network in ADHD". Journal of Neuroscience Methods. 169 (1): 249–254. doi:10.1016/j.jneumeth.2007.11.031.
{{cite journal}}: Explicit use of et al. in:|last7=(help)CS1 maint: Explicit use of et al. (link) - ↑ Wurina, Zang; Zhao, S. G. (2012). "Resting-state fMRI studies in epilepsy". Neuroscience Bulletin. 28 (4): 449–455. doi:10.1007/s12264-012-1255-1.
- ↑ Tessitore, A.; Amboni, M.; Esposito, F.; Russo, A.; Picillo, M.; Marcuccio, L.; et al. (2012). "Resting-state brain connectivity in patients with Parkinson's disease and freezing of gait". Parkinsonism & Related Disorders. 18 (6): 781–787. doi:10.1016/j.parkreldis.2012.03.018.
{{cite journal}}: Explicit use of et al. in:|last7=(help)CS1 maint: Explicit use of et al. (link) - ↑ Li, P.; Li, S. F.; Dong, Z. Y.; Luo, J.; Han, H. Y.; Xiong, H. F.; et al. (2012). "Altered resting state functional connectivity patterns of the anterior prefrontal cortex in obsessive-compulsive disorder". NeuroReport. 23 (11): 681–686. doi:10.1097/wnr.0b013e328355a5fe.
{{cite journal}}: Explicit use of et al. in:|last7=(help)CS1 maint: Explicit use of et al. (link) - ↑ Otti, A; Guendel, H; Wohlschlager, A; Zimmer, C; Noll-Hussong, M (2013). "Frequency shifts in the anterior default mode network and the salience network in chronic pain disorder". BMC Psychiatry. 13: 84. doi:10.1186/1471-244x-13-84.
- ↑ Otti, A; Guendel, H; Henningsen, P; Zimmer, C; Wohlschlaeger, AM; Noll-Hussong, M (Jan 2013). "Functional network connectivity of pain-related resting state networks in somatoform pain disorder: an exploratory fMRI study". J Psychiatry Neurosci. 38 (1): 57–65. doi:10.1503/jpn.110187.
- ↑ Gaudio S, Wiemerslage L, Brooks SJ, Schiöth HB (2016). "A systematic review of resting-state functional-MRI studies in anorexia nervosa: Evidence for functional connectivity impairment in cognitive control and visuospatial and body-signal integration". Neurosci Biobehav Rev. 71: 578–589. doi:10.1016/j.neubiorev.2016.09.032. PMID 27725172.
- ↑ Fox, M. D.; Greicius, M. (2010). "Clinical applications of resting state functional connectivity". Front Syst Neurosci. 4: 19.
